Forschungsreport
Coxiella burnetii bei Schafen
Förderkennzeichen: Projekt-Nr.0205E
Auftragnehmer: Tierärztin Nadja Breitling aus Metzingen
Projektleitung: Dr. Reinhard Sting, Chemisches und Veterinäruntersuchungsamt Stuttgart
Kurzfassung:
Problemstellung
Q-Fieber, das durch den Erreger Coxiella burnetii (C. burnetii) hervorgerufenen wird, ist eine immer wieder
auftretende klassische Zoonose, die in den letzten Jahren allgemein beim Menschen zugenommen hat (Hellenbrand et al., 2001; Kimmig et al.,
2000, Reintjes et al., 2000, Robert Koch-Institut, 2002). So traten Q-Fieber-Epidemien in den letzten Jahren vor allem in
Baden-Württemberg aber auch in Hessen und in Nordrhein-Westfalen auf (Hellenbrandt et al., 2001; Robert Koch-Institut, 2002, 2003a,
2003b; Universitätsklinikum Tübingen, 2002). Nicht allein die akuten Infektionen mit sehr schweren und teilweise tödlichen
Verläufen sondern auch chronische Q-Fieber-Erkrankungen, denen durch Untersuchungen in Frankreich ein hoher Anteil von Herzbeschwerden
angelastet wird (Fournier et al., 1998), können eine große Bedeutung bei der Gefährdung der Gesundheit des Menschen haben
(Maurin, Raoult, 1999; Edlinger, 1987). Aufgrund gehäuft auftretender Q-Fieber-Erkrankungen im Großraum Tübingen
(Universitätsklinikum Tübingen, 2002) und der im Vergleich zu anderen Bundesländern höchsten Prävalenz beim
Menschen von 1979 bis 1999 in Baden-Württemberg (Hellenbrand et al., 2001) kam es im Jahr 2000 zu einem Expertengespräch im
Ministerium Ländlicher Raum Baden-Württemberg mit dem Ziel, Wege der Bekämpfung, Diagnostik und Prophylaxe des Q-Fiebers zu
erarbeiten. Einigkeit bestand darüber, dass in Baden-Württemberg nicht nur dem Schaf sondern auch der Schafzecke (Zecken der
Gattung Dermacentor) besondere Aufmerksamkeit als mögliche Infektionsquellen geschenkt werden muss.
Aktuelle Daten zum Vorkommen von C. burnetiiinfizierten Schafzecken sowie serologische Untersuchungen in
Baden-Württemberg liegen bereits längere Zeit zurück und serologische Daten, die mittels der sensitiven ELISA-Technik
ermittelt worden sind, fehlen vollständig.
Ziel
Ziel dieser Arbeit war es deshalb, Felduntersuchungen mittels direktem und indirektem Erregernachweis
durchzuführen, um aktuelle Daten möglicher Infektionsquellen als Grundlage der Überwachung dieser Zoonose und effektiver
Präventionsmaßnahmen gegen die Verbreitung des Q-Fieber-Erregers zu erhalten.
Weiteres Ziel ist es, empfindliche Labormethoden des Nachweises von Coxiella burnetii zu erarbeiten, die es dem CVUA Stuttgart
ermöglich, Untersuchungen zur Überwachung von Schafherden wie auch im Falle von Q-Fieber-Erkrankungen durchführen zu
können. Hierdurch sollen vorbeugende Maßnahmen sowie Maßnahmen im Q-Fieberfall zum Schutz von Mensch und Tier gezielter
eingeleitet werden können. Diese Ziele wurden auch in einem Leitfaden und Maßnahmenkatalog formuliert, der auf der Grundlage
eines Expertengesprächs im Ministerium für Ländlichen Raum Baden-Württemberg in Kooperation des Landesgesundheitsamtes
Baden-Württemberg, des Schafherdengesundheitsdienst der Tierseuchenkasse Baden-Württemberg und des Chemischen und
Veterinäruntersuchungsamtes Stuttgart erarbeitet worden ist.
Untersuchungsmethoden
- Nachweis von Coxiella brnetii in Schafvlies, Zecken und Zeckenkot mittels nested-PCR
- Sequenzierung der mittels PCR gewonnenen DNA-Amplifikate zur Bestätigung der PCR-Ergebnisse
- Nachweis von Antikörpern gegen Coxiella burnetii mit Hilfe der Komplementbindungs-reaktion (KBR) als klassischer serologischer Methode und vergleichend mit Hilfe eines selbsthergestellten empfindlichen ELISA-Tests
Ergebnis
Erregernachweis von C. burnetii mittels PCR
Nachweisgrenze der PCR
Als Nachweisgrenze der PCR konnten 102 bis 103 C. burnetii-Partikel ermittelt werden. Ein negativer Einfluss des Probenmaterials aus Zecken oder Zeckenkot auf die PCR konnte in keinem der Fälle nachgewiesen werden.
Nachweis von C. burnetii in Zecken und Zeckenkot
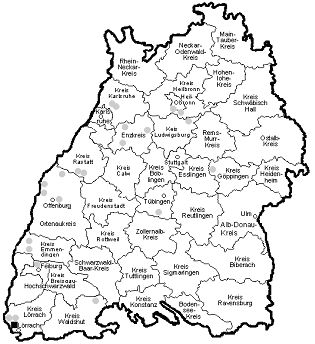
In einer der insgesamt 1066 in 23 Herden aus 22 Regionen in Baden-Württemberg gesammelten Zecke konnte aus einer Schafherde bei Efringen-Kirchen im Landkreis Lörrach (Regierungsbezirk Freiburg) konnte C. burnetii mittels PCR nachgewiesen werden. Dabei handelte es sich um eine ungesaugte Zecke. Ebenso ergaben die Untersuchungen bei einer der 48 aus 18 Herden gesammelten Zeckenkotproben aus dem Vlies von Schafen der oben genannten Schafherde ein positives Ergebnis (s. Abbildung 1, schwarzes Quadrat).
Abbildung 1: Sammelorte von Zecken und Zeckenkot in Baden-Württemberg (markiert mit Quadrat- und Kreissymbolen).
Die Nukleotidsequenzen der PCR-Produkte (420 bp) aus einer Zecke und aus Zeckenkot zeigten eine vollständige
Übereinstimmung mit den Sequenzen der positiven Kontrolle. Ein Abgleich dieser Nukleotidsequenzen mit anderen Sequenzen der Datenbank
des Blast-Programms ergab Homologien zu bekannten Sequenzen von C. burnetii von 100%.
Serologische Untersuchungen
Komplementbindungsreaktion (KBR)
Von den insgesamt 3460 untersuchten Schafseren aus 4 den Regierungsbezirken Baden-Württembergs zeigten 18 Seren Titerstufen von 1:10 (positive Seren) und größer. Die Ergebnisse der Seren aus den einzelnen Regierungsbezirken sind in Tabelle 4 zusammengefasst dargestellt
Tabelle 4: Untersuchungen von Schafseren auf Antikörper gegen C. burnetii mittels KBR.
|
Regierungsbezirk |
Probenanzahl |
Anzahl positiver Seren |
% positive Seren |
|
Stuttgart |
1616 |
4 |
0,2 |
|
Tübingen |
846 |
12 |
1,4 |
|
Freiburg |
781 |
2 |
0,3 |
|
Karlsruhe |
217 |
0 |
0 |
|
Gesamt |
3460 |
18 |
0,5 |
Die Untersuchungen der 100 Seren aus einer Q-Fieber-verdächtigen Schafherde ergaben bei insgesamt 6 (6%) der
Seren KBR-Titerstufen von 1:10 und größer.
ELISA
Die Festlegung eines Cut off-Wertes für den ELISA wurde in Bezug auf die KBR-Ergebnisse vorgenommen. Eine
Auswertung erfolgte mit Hilfe des Programms Win Epis-cope 2.0 (Thrusfield et al., 2001) und ergab bei Festlegung eines Cut off-Wertes von
0,4 eine Gesamtübereinstimmung von KBR und ELISA von 90,5%.
Die Ergebnisse der serologischen Untersuchungen der Schafseren aus den einzelnen Regierungsbezirken mittels ELISA stellen sich wie in der
unten aufgeführten Tabelle 6 dar.
Tabelle 6: Untersuchungen von Schafseren aus den vier Regierungsbezirken Baden-Württembergs auf Antikörper gegen C. burnetii mittels ELISA.
| Regierungsbezirk | Probenanzahl | Probenanzahl Anzahl positiver Seren | % positive Seren |
| Stuttgart |
1616 |
140 |
8,7 |
| Tübingen |
846 |
78 |
9,2 |
| Freiburg |
781 |
80 |
10,2 |
| Karlsruhe |
217 |
2 |
0,9 |
| gesamt |
3460 |
300 |
8,7 |
Die Untersuchungen der 100 Seren aus einer Q-Fieber-verdächtigen Schafherde ergaben bei insgesamt 53 (53%) der Seren positive Ergebnisse.
Vergleich zwischen KBR und ELISA
Ein Vergleich zwischen KBR und ELISA wurde unter Berücksichtigung der erzielten Titerstufen durchgeführt.
Hierbei zeigte sich einerseits, dass von 14 Seren mit niedrigen KBR-Titerstufen von 1:10 vier Seren Indexwerte von <0,4 im ELISA
aufwiesen und somit als negativ zu bewerten waren. Andererseits wiesen 6 von 14 Seren hohe Indexwerte von >0,8 auf und konnten eindeutig
als positiv bewertet werden. Seren hingegen mit KBR-Titerstufen von 1:20 und größer zeigten alle im ELISA Indexwerte von >0,4
und größer und somit eindeutig positive Reaktionen.
Betrachtet man die Seren (3202) mit negativem KBR-Ergebnis fällt auf, dass von diesen 334 im ELISA Indexwerte von >0,4 erreichten
und als positive Reaktionen zu bewerten waren.
Konsequenzen für die Praxis
Gehäuft aufgetretene Q-Fieber-Epidemien beim Menschen in Baden-Württemberg (Kim-mig et al., 2000;
Universitätsklinikum Tübingen, 2002) sowie Hessen und Nordrhein-Westfalen (Hellenbrand, 2001; Robert Koch-Institut, 2003a, 2003b)
mit z.T. sehr schweren Krankheitsbildern rücken diese Epidemien in den Vordergrund unter den Zoonosen. Über eine Zunahme von
Q-Fieber-Erkrankungen beim Menschen in den 90er Jahren berichten auch Hellenbrand et al. (2001) und Reintjes et al. (2000). Kröner
(1995), Reintjes et al. (2000) und Schneider et al. (1993) gehen sogar von einer zunehmenden Gefahr von Q-Fieber-Infektionen in der
Nähe städtischer Gebiet oder sogar Großstädten aus.
Durch solche Q-Fieber-Epidemien entsteht erhebliches Leiden bei den betroffenen Personen sowie Kosten für das öffentliche
Gesundheitswesen. Neben diesen akuten Krankheitserscheinungen kommen die Folgen chronischer Q-Fieber-Erkrankungen hinzu, die sich z.T. als
mit Todesfolgen einhergehende Endokarditisfälle darstellen (Fournier et al., 1998). Maurin und Raoult (1999) schätzen für
Frankreich den durch Q-Fiberinfektionen bedingten Anteil an Endokarditisfällen auf sogar 5%. Q-Fieber-Infektionen beim Menschen sind
überwiegend auf Kontakt mit Schafen, Damwild oder Zootieren zurückzuführen (Rolle und Mayr, 2002; Kimmig et al., 1997),
wobei der vermehrte Kontakt zwischen Mensch und Schaf durch eine zunehmende Zersiedelung ländlicher Regionen zu einer
Verschärfung der Situation führt (Hellenbrand et al., 2001). Im Infektionsgeschehen spielen Wanderschafherden eine besondere
Rolle, so dass Infektionsquellen oftmals nicht mehr einer bestimmten Herde zugeordnet oder lokalisiert werden können. Um so wichtiger
sind Untersuchungen zu möglichen Hauptinfektionsquellen sowie daraus resultierende Empfehlungen zu prophylaktischen Maßnahmen.
Aus diesem Grunde wurden vom Ministerium für Ländlichen Raum Baden-Württemberg Untersuchungen zur Q-Fieber-Situation bei
Schafen in Baden-Württemberg unterstützt.
Gebiete im südlichen Rheintal stellen sich nach wie vor als Endemiegebiet für C. burnetii-infizierte Zecken dar. Dies
haben Untersuchungen von Zecken und Zecken-kot mittels PCR in dieser Arbeit gezeigt. Bereits 1978 konnte Liebisch in derselben
Re-gion C. burnetii infizierte Zecken nachweisen. Auffallend war in unseren Untersuchungen, dass C. burnetii sowohl in einer ungesaugten
Zecke als auch Zeckenkot, einer sehr wichtigen Infektionsquelle für den Menschen, nachgewiesen werden konnte. Durch eine
transovarielle Übertragung des Erregers von Zecke zu Zecke und schließlich einer massenhaften Erregerausscheidung über
Zeckenkot (Schliesser, 1991) ist über zeckenbefallene Schafe eine Erregerverbreitung und ein Kontakt des Erregers aus dem sog.
Naturzyklus der Wildtiere (Babudieri, 1959) indirekt zum Menschen möglich. Einer Verbreitung von C. burnetii über das Vlies von
Schafen, die in Wanderherden aus ihren Winterquartieren im Rheintal auf die Sommerquartiere der Schwäbischen Alb gelangen, leistet
aufgrund des dort überwiegend ariden Klimas einer aerogenen Infektion Vorschub (Dedié und Bostedt, 1985; Hellenbrand et al.,
2001; Marrie und Raoult, 1995; Tissot Dupont et al., 1999). Es ist somit davon auszugehen, dass auch ein geringer Anteil mit C. burnetii
befallener Zecken in Schafherden aufgrund einer lebenslangen Persistenz des Erregers in Zecken sowie einer transovariellen Weitergabe des
Erregers an die nächste Zeckengeneration, einer Virulenzsteigerung durch Zeckenpassagen (Brezina und Rehacek, 1961), einer
massenhaften Erregerausscheidung über Zeckenkot von bis zu 1012 Keime pro Gramm (Liebisch, 1977; Nassal, 1982, Schliesser, 1991), der
sehr hohen Tenazität von C. burnetii in der Umwelt (Ormsbee, 1972), und geringer Infektionsdosen von nur wenigen Keimen (Raoult und
Marrie, 1997) zu einer effektiven Erregerausbreitung führen kann. Erschwerend könnte hinzukommen, dass eine Ausbreitung
der Schafzecke in andere Gebiete zu befürchten ist. Aufgrund der in den letzten Jahren milden Winter wurde bereits über
Zeckenbefall bei Schafen berichtet, die im Frühjahr nicht im Rheintal gewesen sind (persönliche Mitteilung eines Schafhalters).
Die serologischen Untersuchungen zufällig entnommener Proben aus Schafherden zeigen unter Anwendung der KBR bei bis zu 1,4% und
mittels ELISA bei bis zu 10,2% der Seren positive Ergebnisse. Hierbei ist zu beachten, dass 5 der 14 Seren mit KBR-Titerstufen von 1:10
Indexwerte im ELISA von <0,4 und 9 Indexwerte von >0,4 aufwiesen. Außerdem ließen sich Titerstufen von 1:10 im Gegensatz zu
Titerstufen von >1:20 in Wiederholungsuntersuchungen nicht in jedem Fall bestätigen (Ergebnisse nicht dargestellt). Mölle und
Hentschke (1993) beurteilen deshalb KBR-Titerstufen von 1:10 beim Schaf als negativ oder fraglich. So ließen sich auch bei Anwendung
der ELISA-Technik nur 64,2% aller Seren mit KBR-Titerstufen von 1:10, hingegen alle KBR-Titerstufen von >1:20 als positive
ELISA-Ergebnisse bestätigen. Dem entgegen zeigten auch in wiederholten Untersuchungen zahlreiche Seren (334), die in der KBR keine
Titerstufen aufwiesen, im ELISA positive Reaktionen.
Ein Vergleich der serologischen Ergebnisse zufällig entnommener Proben und Proben aus einer Q-Fieberverdächtigen Herde zeigen
deutliche Unterschiede. Während in Baden-Württemberg mit einer durchschnittlichen Seroprävalenz für Q-Fieber von 0,5%
(0-1,4%) mittels KBR und von 8,7% (0,9-10,2%) mittels ELISA ausgegangen werden kann, fand sich in einem Q-Fieber-verdächtigen Betrieb
eine Seroprävalenz von 6% (KBR) bzw. 53% (ELISA). Diese Ergebnisse zeigen, dass der ELISA-Technik aufgrund der höheren
Sensitivität und besseren Reproduzierbarkeit der Ergebnisse für serologische Untersuchungen der Vorzug zu geben
ist.
Auf der Grundlage der Ergebnisse dieser Arbeit lassen sich zu Untersuchungen in Q-Fieber-verdächtigen
Herden, Prophylaxemaßnahmen und Kontrolluntersuchungen die im folgenden aufgeführten Empfehlungen aussprechen.
1. Untersuchungen in Q-Fieber-verdächtigen Herden:
- Untersuchungen von Zecken und Zeckenkot auf C. burnetii mittels PCR.
- Serologische Untersuchungen von Schafen: bei einer Seroprävalenz von >5% (KBR) oder >20% (ELISA) ist von Q-Fieber-Infektionen in einer Herde auszugehen.
2. Vorbeugende Maßnahmen gegen Q-Fieber-Infektionen:
- Zeckenbehandlung der Schafe in ihren Winterquartieren vor allem im südlichen Rheintal vor dem Aktivitätsgipfel der Schafzecken im zeitigen Frühjahr (Januar/Februar) mit Hilfe von langwirkenden Akaraziden.
- Oberflächendesinfektion mit Zeckenkot behafteter Schafe durch ein Oberflächendesinfektionsmittel in Form einer Badebehandlung.
- Scheren von Schafen unter besonderen Schutzmaßnahmen (Atemschutz, geschlossene Stallungen) bei Befall mit Zeckenkot und unschädliche Beseitigung mit Zeckenkot behafteter Schafwolle.
- Behandlung von Herden mit Q-Fieber bedingenten Aborten mit Tetrazyklinen zur Verringerung der Erregerausscheidung (persönliche Mitteilung, Steng, Schafherdengesundheitsdienst Stuttgart der Tierseuchenkasse Baden-Württemberg).
- Serologische Kontrolluntersuchungen neu zugekaufter Tiere mittels ELISA.
3. Weiterführende Untersuchungen:
- Gezielte Untersuchungen von Schafzecken aus Regionen des südlichen Rheintals zur Bestätigung eines dort möglichen stark ausgeprägten C. burnetii-Vorkommens bei dieser Zeckenart.
- Untersuchungen weiterer Zeckenarten wie Ixodes ricinus (gemeiner Holzbock).
- Auf Stichproben basierende Untersuchungen von Schafseren, die zur Brucellose-Untersuchungen entnommen werden mittels ELISA auf Q-Fieber, um bezüglich der Seroprävalenz des Q-Fiebers beim Schaf auf dem Laufenden zu bleiben.
- Sammlung von C. burnetii-Isolaten durch Anzüchtung des Erregers vor allem bei Q-Fieber-Ausbrüchen zum Zwecke von Stammcharakterisierungen (Zusammenarbeit mit dem nationalen Referenzlabor für Q-Fieber des Friedrich-Loeffler-Instituts - Bundesinstitut für Tiergesundheit -, Standort Wusterhausen/Dosse).
Literaturhinweise
- Babudieri, B. (1959): Q fever: a zoonosis. Adv. Vet. Sci. 5, 81.
- Blast-Programm des National Center of Biotechnology Information (NCBI). Internet-Adresse: www.ncbi.nlm.nih.gov
- Brezina, R., J. Rehacek (1961): A study of the phase variations phenomenon by experimental infection of the tick Dermacentor
marginatus (Sulzer) with Coxiella burnetii. Acta Virol. 5, 250-254.
- Dedié, K, H. Bostetdt (1985): Q-Fieber. In: Schafkrankheiten, Verlag Eugen Ulmer Stuttgart, 58-60.
- Edlinger, E.A. (1987): Chronic Q fever. Zbl. Bakt. Hyg. A 267, 51-56.
- Fournier, P.-E., T.J. Marrie, D. Roult (1998): Diagnosis of Q fever. J. Clin. Microbiol. 36, 1823-1834.
- Hellenbrand, W., L. Petersen, T. Breuer (2001): Changing Epidemiology of Q fever in Germany; 1947-1999. Emerg. Infect. Dis., 7 (5),
789-96.
- Kimmig, P., J. Simmert, R. Sting, W. Rietschel (1997): Q-Fieber-Ausbruch durch infizierte Damwildherde. Epidem. Bull. 36,
249-250.
- Kimmig, P., G. Pfaff, R. Sting, G. Steng (2000): Kooperation vom medizinischen und veterinärmedizinischen Behörden beim
Auftreten von Q-Fieber-Epidemien. Landesge-sundheitsamt Baden-Württemberg. Jahresbericht 2000, 55-56.
- Kröner, B. ()1995): Q-ieber – auch in Großstädten eine Gefahr. Deutsches Ärzteblatt 92, 378-381.
- Liebisch, A. (1977): Das Q-Fieber als Naturherdinfektion in Süddeutschland. Bundesgesundheitsblatt 20 Nr.14, 185-191.
- Liebisch, A., W. Burgdorfer, M.S. Rahman (1978): Epidemiologische Untersuchungen an Schafzecken (Dermacentor marginatus) auf
Infektionen mit Rickettsien. Dtsch. Tie-rärztl. Wschr. 85, 121-126.
- Marrie, T.J., D. Raoult (1997): Q fever – a review and issues for the next century. Int. J. Antimirobiol. Agents 8,
145-161.
- Maurin, M., D. Raoult (1999): Q Fever. Clin. Microbiol. Rev. 12, 518-553.
- Mölle, G., J. Hentschke (1993): Q-Fieber-Epidemie bei Schafen: Diagnostische Maßnahmen. Tagung der Fachgruppe
„Krankheiten der kleinen Wiederkäuer, Thema: „Schaf- und Ziegenkrankheiten“. Tagungsbericht der Deutschen
Veterinärmedizinischen Gesellschaft (DVG), 39-44.
- Nassal, J. (1982): Q-Fieber. Eine klassische Zooanthroponose. Tierärztl. Umsch. 37, 109-114.
- Ormsbee, R.A. (1972): Q fever rickettsia. In: Viral and rickettsial infections of man (Horsfall, F.L.J.C., I. Tamm) 4th ed.
Philadelphia: JB Lippincott, 1144-1160.
- Philip, C.B. (1948): Observation on experimental Q-fever. J. Parasiol. 34, 457.
- Raoult, D., T.J. Marrie (1997): Q fever. Clin. Infect. Dis. 20, 489-496.
- Reintjes, R., W. Hellenbrand, A. Düsterhaus (2000): Q-Fieber-Ausbruch in Dortmund im Sommer 1999. Gesundheitswesen 62,
1-6.
- Robert Koch-Institut (2002): Q-Fieber. Epidemiologisches Bulletin 37, 313-314.
- Robert Koch-Institut (2003a): Zu einem Q-Fieber-Ausbruch im Landkreis Soest. Epide-miologisches Bulletin 44, 353-355.
- Robert Koch-Institut (2003b): Q-Fieber. Epidemiologisches Bulletin 46, 378-379.
- Rolle, M., A. Mayr (2002): Medizinische Mikrobiologie, Infektions- und Seuchenlehre. Ferdinand Enke Verlag Stuttgart.
- Schliesser, T. (1991): Zur Epidemiologie und Bedeutung des Q-Fiebers bei Tieren. Wien. Tierärztl. Mschr. 78, 7-12.
- Schneider, T., H.-U. Hahn, D. Steinhoff, H.-M. Guschoreck, O. Liesenfeld, H. Mäter-Böhm (1993): Q-Fieber-Epidemie in
Berlin. Dtsch. Med. Wschr. 118, 689-695.
- Thrusfield, M., C. Ortega, I. De Blas, J.P. Noordhuizen, K. Frankena (2001): Win Epis-cope 2.0: improved epidemiological software
for veterinary medicine. Vet. Rec. 148 (18), 567-572.
- Tissot Dupont, H., S. Torres, M. Nezri, D. Raoult (1999): A hyperendemic Q fever re-lated to sheep and wind. Amer. J. Epidemiol.
150, 67-74.
- Universitätsklinikum Tübingen (2002): Q-Fieber in Baden-Württemberg. Newslettter 2/2002
des Instituts für Medizinische Mikrobiologie und Krankenhaushygiene des Universitätsklinikums der Eberhard-Karls-Universität
Tübingen.